
En el caso de muchos globos se elevan gracias al aire que calientan los quemadores de propano instalados en la boca. La envoltura, o cubierta, está elaborada con un tejido sintético tratado con poliuretano para minimizar las fugas. De la cubierta cuelga una barquilla, o cesto, que transporta al piloto y los pasajeros.
¿POR QUE SE COSE MAS RAPIDO LOS ALIMENTOS EN UNA OLLA DE PRECON O EN UNA COMUN?


se cose mas rapido por que no deja salir el vapor
¿ LAPRECION DEL AIRE EN LAS LLANTAS DE UN AUTO MOVIL SERA DIFERENTE O IGUAL EN VERANO QUE EN INVIERNO
Lo que si varia es la cantidad de aire que tengas que meter en las cubiertas para llegar a la presion deseada. En verano será menos cantidad. En invierno será mas cantidad.
¿QUE SUCEDE SI SUMERJES UN VASO VACIO BOCA ABAJO EN UN RECIPIENTE CON AGUA?
¿QUE SUCEDE SI SUMERJES UN VASO VACIO BOCA ABAJO EN UN RECIPIENTE CON AGUA?
Se llena de agua solamente la mitad del vaso, ya que el aire en la otra mitad no permite qe las moleculas de agua pudan llenar completamente el vaso.
En los siguientes Link's se pueden observar algunos videos acerca de la fisica y el fenomeno de los gases :
http://www.youtube.com/watch?v=nNA0BDftl5I
http://www.youtube.com/watch?v=EgGzI75pQdE
http://www.youtube.com/watch?v=m1M0cXoZ7EA
En los siguientes Link's se pueden observar algunos videos acerca de la fisica y el fenomeno de los gases :
http://www.youtube.com/watch?v=nNA0BDftl5I
http://www.youtube.com/watch?v=EgGzI75pQdE
http://www.youtube.com/watch?v=m1M0cXoZ7EA
Ley de los gases ideales
La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales, sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). Los gases reales que más se aproximan al comportamiento del gas ideal son los gases monoatómicos en condiciones de baja presión y alta temperatura.
Empíricamente, se observan una serie de relaciones entre la temperatura, la presión y el volumen que dan lugar a la ley de los gases ideales, deducida por primera vez por Émile Clapeyron en 1834.
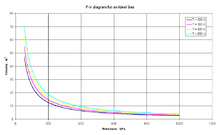
La ecuación de estado para gases reales
| Valores de R |
|---|
 |
 |
 |
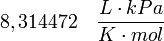 |
 |
 |
 |
 |
 |
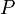 = Presión del gas
= Presión del gas = Volumen del gas
= Volumen del gas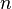 = Moles de gas.
= Moles de gas.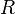 = Constante universal de los gases ideales
= Constante universal de los gases ideales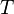 = Temperatura.
= Temperatura. y
y 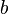 son constantes determinadas por la naturaleza del gas con el fin de que haya la mayor congruencia posible entre la ecuación de los gases reales y el comportamiento observado experimentalmente.
son constantes determinadas por la naturaleza del gas con el fin de que haya la mayor congruencia posible entre la ecuación de los gases reales y el comportamiento observado experimentalmente.
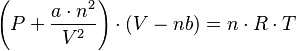
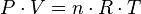
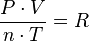


No hay comentarios:
Publicar un comentario